Exemplo De Atomos Unidos Por Forças De Van Der Waals – Exemplo De Átomos Unidos Por Forças De Van Der Waals: Uma Exploração Detalhada – Mergulhe no fascinante mundo das forças intermoleculares, onde as forças de Van der Waals desempenham um papel fundamental na ligação de átomos e moléculas. Estas forças, embora relativamente fracas, são cruciais para a compreensão de diversas propriedades físicas e químicas das substâncias, influenciando diretamente o ponto de fusão, ebulição e solubilidade.
Prepare-se para desvendar os mistérios dessas forças e suas implicações em áreas como química, biologia e engenharia.
As forças de Van der Waals, também conhecidas como forças de dispersão de London, são interações eletrostáticas que surgem devido à flutuação momentânea na distribuição de elétrons em átomos e moléculas. Essas flutuações criam polos temporários que induzem polos opostos em moléculas adjacentes, resultando em uma atração fraca.
As forças de Van der Waals são classificadas em três tipos: forças de London, dipolo-dipolo e ligação de hidrogênio. As forças de London são as mais comuns e atuam entre todas as moléculas, enquanto as forças dipolo-dipolo ocorrem entre moléculas polares, e as ligações de hidrogênio são um tipo especial de força dipolo-dipolo que envolve um átomo de hidrogênio ligado a um átomo pequeno e altamente eletronegativo, como oxigênio, nitrogênio ou flúor.
Introdução às Forças de Van der Waals
As forças de Van der Waals são forças intermoleculares fracas que surgem da interação entre moléculas polares ou apolares. Elas são responsáveis por muitas das propriedades físicas e químicas das substâncias, incluindo o ponto de fusão, o ponto de ebulição e a solubilidade.
As forças de Van der Waals são essenciais para a vida, pois ajudam a manter as moléculas juntas e permitem que elas interajam umas com as outras.
Tipos de Forças de Van der Waals
Existem três tipos principais de forças de Van der Waals: forças de London, forças dipolo-dipolo e ligações de hidrogênio.
- Forças de London: As forças de London são o tipo mais fraco de forças de Van der Waals e surgem da interação entre os dipolos instantâneos induzidos em moléculas apolares. Os dipolos instantâneos são criados pela flutuação aleatória dos elétrons em uma molécula.
Essas flutuações criam um momento dipolar temporário, que pode induzir um momento dipolar em uma molécula adjacente. A interação entre esses dipolos instantâneos induzidos é conhecida como força de London.
- Forças dipolo-dipolo: As forças dipolo-dipolo são mais fortes que as forças de London e surgem da interação entre os dipolos permanentes em moléculas polares. Moléculas polares têm um momento dipolar permanente devido à distribuição desigual de elétrons. As moléculas polares se atraem umas às outras porque o pólo positivo de uma molécula é atraído pelo pólo negativo de outra molécula.
Essas interações são conhecidas como forças dipolo-dipolo.
- Ligações de hidrogênio: As ligações de hidrogênio são o tipo mais forte de forças de Van der Waals e surgem da interação entre um átomo de hidrogênio ligado a um átomo altamente eletronegativo (como oxigênio, nitrogênio ou flúor) e um par de elétrons não compartilhados em um átomo eletronegativo em uma molécula adjacente.
As ligações de hidrogênio são responsáveis por muitas das propriedades únicas da água, como seu alto ponto de ebulição e sua capacidade de dissolver muitas substâncias.
Exemplos de Moléculas que Exibem Forças de Van der Waals
- Forças de London: Metano (CH 4), etano (C 2H 6), propano (C 3H 8)
- Forças dipolo-dipolo: Cloreto de hidrogênio (HCl), água (H 2O), amônia (NH 3)
- Ligações de hidrogênio: Água (H 2O), álcool (CH 3OH), amônia (NH 3)
Átomos Unidos por Forças de Van der Waals: Exemplo De Atomos Unidos Por Forças De Van Der Waals
As forças de Van der Waals desempenham um papel crucial na determinação das propriedades físicas e químicas das substâncias. Essas forças intermoleculares afetam o estado físico (sólido, líquido ou gasoso), o ponto de fusão, o ponto de ebulição, a viscosidade e a solubilidade das substâncias.
Influência das Forças de Van der Waals nas Propriedades Físicas e Químicas
- Ponto de Fusão e Ponto de Ebulição: As forças de Van der Waals mais fortes resultam em pontos de fusão e ebulição mais altos. Isso ocorre porque mais energia é necessária para superar as forças intermoleculares e separar as moléculas umas das outras.
- Solubilidade: As forças de Van der Waals também influenciam a solubilidade das substâncias. As substâncias que são capazes de formar forças de Van der Waals fortes umas com as outras tendem a ser solúveis umas nas outras. Por exemplo, a água é um solvente polar e pode formar ligações de hidrogênio fortes com outras moléculas polares, como o álcool.
Já substâncias apolares, como o óleo, não podem formar ligações de hidrogênio com a água e, portanto, são insolúveis em água.
- Viscosidade: A viscosidade de um líquido é uma medida de sua resistência ao fluxo. Os líquidos com forças de Van der Waals mais fortes tendem a ser mais viscosos. Isso ocorre porque as moléculas são mais fortemente atraídas umas às outras e, portanto, são mais difíceis de se moverem umas em relação às outras.
Comparação com Outras Forças Intermoleculares
As forças de Van der Waals são mais fracas que outras forças intermoleculares, como as ligações de hidrogênio. As ligações de hidrogênio são responsáveis por muitas das propriedades únicas da água, como seu alto ponto de ebulição e sua capacidade de dissolver muitas substâncias.
As forças de Van der Waals, embora mais fracas, ainda são importantes para muitas propriedades físicas e químicas das substâncias.
Exemplos de Átomos Unidos por Forças de Van der Waals
Aqui está uma tabela com exemplos de substâncias que são mantidas juntas por forças de Van der Waals. A tabela mostra o nome da substância, sua fórmula química e o tipo de força de Van der Waals predominante.
| Nome da Substância | Fórmula Química | Tipo de Força de Van der Waals Predominante |
|---|---|---|
| Metano | CH4 | Forças de London |
| Etano | C2H6 | Forças de London |
| Propano | C3H8 | Forças de London |
| Cloreto de hidrogênio | HCl | Forças dipolo-dipolo |
| Água | H2O | Ligações de hidrogênio |
| Álcool | CH3OH | Ligações de hidrogênio |
| Amônia | NH3 | Ligações de hidrogênio |
As propriedades físicas e químicas de cada substância são influenciadas pelo tipo de força de Van der Waals predominante. Por exemplo, o metano, o etano e o propano são gases à temperatura ambiente porque as forças de London são muito fracas para mantê-los juntos no estado líquido.
A água, por outro lado, é um líquido à temperatura ambiente porque as ligações de hidrogênio são muito fortes para permitir que as moléculas de água escapem para o estado gasoso.
Aplicações das Forças de Van der Waals
As forças de Van der Waals têm aplicações em uma variedade de campos, incluindo química, biologia, engenharia e ciência dos materiais.
Aplicações em Química
- Síntese de novos materiais: As forças de Van der Waals são usadas para criar novos materiais com propriedades específicas, como resistência, flexibilidade e condutividade. Por exemplo, os nanotubos de carbono são materiais muito fortes que são mantidos juntos por forças de Van der Waals.
- Estudos de interação molecular: As forças de Van der Waals são importantes para entender como as moléculas interagem umas com as outras. Essa compreensão é essencial para o desenvolvimento de novos medicamentos e materiais.
Aplicações em Biologia
- Interação proteína-proteína: As forças de Van der Waals desempenham um papel crucial nas interações proteína-proteína, que são essenciais para muitas funções biológicas, como a replicação do DNA e a transcrição.
- Reconhecimento molecular: As forças de Van der Waals são usadas para o reconhecimento molecular, que é o processo pelo qual as moléculas se ligam umas às outras de forma específica. Essa capacidade é essencial para muitas funções biológicas, como a sinalização celular e a imunidade.
Aplicações em Engenharia
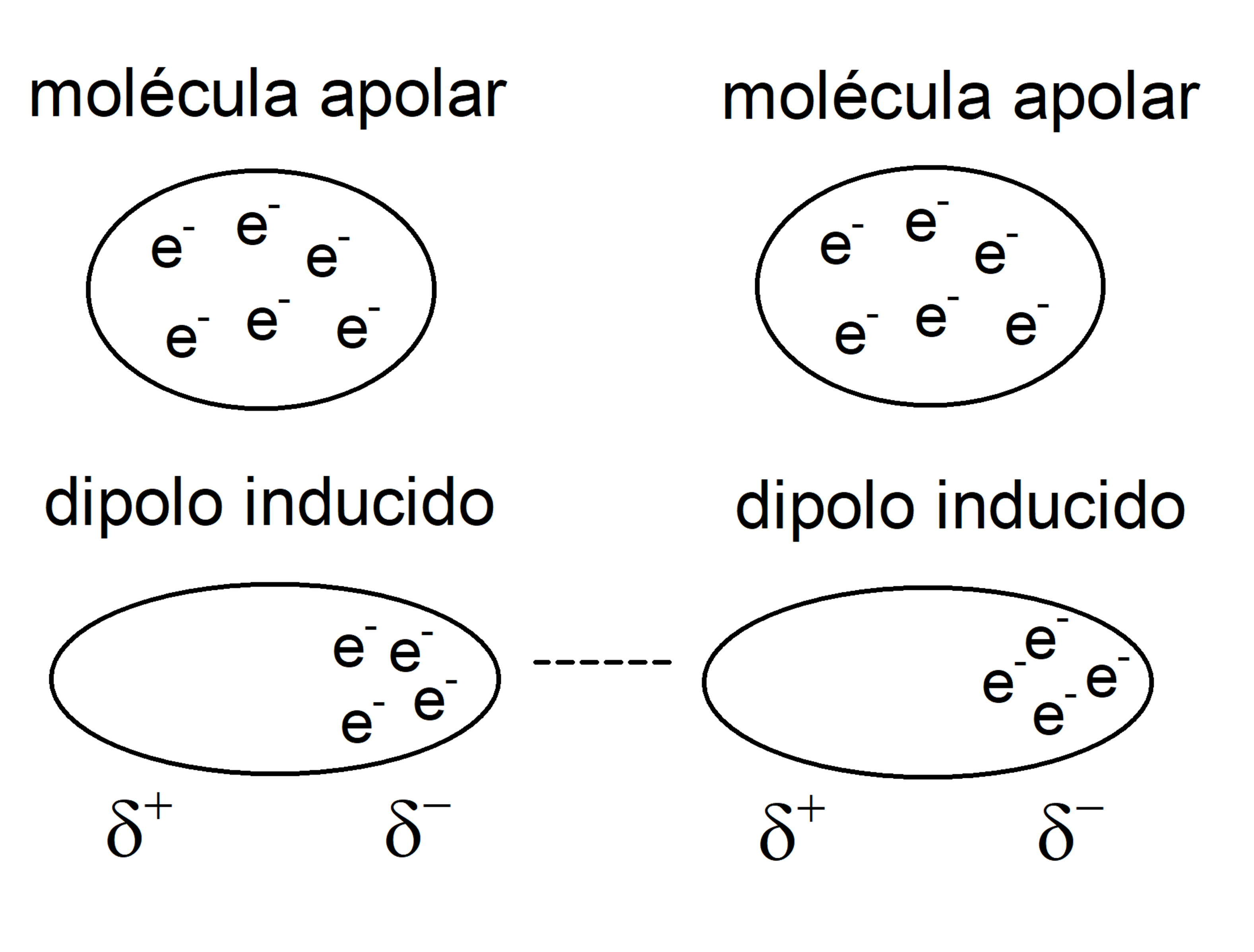
- Lubrificação: As forças de Van der Waals são usadas para criar lubrificantes que reduzem o atrito entre as superfícies. Por exemplo, os lubrificantes usados em motores de carros são geralmente baseados em óleos que formam forças de Van der Waals fortes com as superfícies metálicas.
- Adesão: As forças de Van der Waals são usadas para criar adesivos que se ligam a diferentes superfícies. Por exemplo, as fitas adesivas são geralmente baseadas em polímeros que formam forças de Van der Waals fortes com as superfícies.
Aplicações em Ciência dos Materiais
- Desenvolvimento de novos materiais: As forças de Van der Waals são usadas para criar novos materiais com propriedades específicas, como resistência, flexibilidade e condutividade. Por exemplo, os materiais compostos, como fibra de carbono e fibra de vidro, são criados usando materiais que são mantidos juntos por forças de Van der Waals.
- Nanoengenharia: As forças de Van der Waals são usadas para manipular e montar materiais em nanoescala. Essa capacidade é essencial para o desenvolvimento de novos dispositivos eletrônicos e sensores.
Considerações Adicionais
As forças de Van der Waals desempenham um papel crucial em uma variedade de fenômenos físicos e químicos. Além das aplicações mencionadas acima, as forças de Van der Waals também são importantes para a formação de agregados moleculares, a adsorção de gases, o comportamento de fluidos e a estabilidade de macromoléculas.
Formação de Agregados Moleculares
As forças de Van der Waals podem levar à formação de agregados moleculares, que são grupos de moléculas que são mantidas juntas por forças intermoleculares. Os agregados moleculares podem ser encontrados em uma variedade de sistemas, incluindo soluções, líquidos e sólidos.
A formação de agregados moleculares pode afetar as propriedades físicas e químicas de uma substância, como sua solubilidade, ponto de fusão e ponto de ebulição.
Adsorção de Gases
As forças de Van der Waals também são importantes para a adsorção de gases. A adsorção é o processo pelo qual as moléculas de gás se ligam à superfície de um sólido. As forças de Van der Waals entre as moléculas de gás e a superfície do sólido são responsáveis pela adsorção.
A adsorção é um processo importante em muitas aplicações, como a purificação de gases, o armazenamento de gases e a catálise.
Comportamento de Fluidos
As forças de Van der Waals também influenciam o comportamento de fluidos, como a viscosidade e a tensão superficial. A viscosidade é uma medida da resistência de um fluido ao fluxo. Os fluidos com forças de Van der Waals mais fortes tendem a ser mais viscosos.
A tensão superficial é uma medida da força que mantém as moléculas de um líquido juntas na superfície. Os líquidos com forças de Van der Waals mais fortes tendem a ter uma tensão superficial mais alta.
Estabilidade de Macromoléculas
As forças de Van der Waals também são importantes para a estabilidade de macromoléculas, como proteínas e ácidos nucléicos. As forças de Van der Waals entre os átomos em uma macromolécula ajudam a manter sua estrutura tridimensional. A estrutura tridimensional de uma macromolécula é essencial para sua função.
Por exemplo, a estrutura tridimensional de uma proteína determina sua capacidade de se ligar a outras moléculas e catalisar reações químicas.
Ao explorarmos o papel das forças de Van der Waals em diferentes campos, como química, biologia, engenharia e ciência dos materiais, podemos apreciar sua importância em diversos processos e fenômenos. Desde a formação de agregados moleculares e a adsorção de gases até a estabilidade de macromoléculas e o comportamento de fluidos, as forças de Van der Waals desempenham um papel crucial.
Compreender essas forças nos permite desvendar os mistérios da natureza e aplicar esse conhecimento para o desenvolvimento de novos materiais e tecnologias.

